I. ОБЩА ИНФОРМАЦИЯ
Какво може да замърси мембраните? За да разберем това, ще се възползваме от някои понятия от теорията на хидратацията.
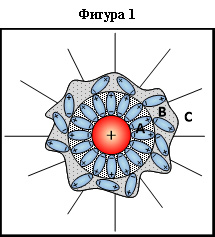 От теорията на хидратацията е известно, че след разтварянето на веществата във вода около техните частици: йони, молекули, малки асоциирани частици, мицели (големи асоциирани частици) се образуват хидратни обвивки. Това означава, че всички частици (с редки изключения), тъй като са заредени, имат тенденция да привличат и ориентират около себе си диполните молекули на водата, т.е. да изкривяват или дори разрушават първоначалната структура на водата. Степента на проява на тази тенденция зависи от размера на заряда и конфигурацията на частицата (фигура 1). При това около йоните, полярните молекули и мицелите се образува двуслойна хидратна обвивка, състояща се от плътен слой от ориентирани молекули на водата (слой A) и по-рехав слой (слой B) от полуориентирани молекули на водата.
От теорията на хидратацията е известно, че след разтварянето на веществата във вода около техните частици: йони, молекули, малки асоциирани частици, мицели (големи асоциирани частици) се образуват хидратни обвивки. Това означава, че всички частици (с редки изключения), тъй като са заредени, имат тенденция да привличат и ориентират около себе си диполните молекули на водата, т.е. да изкривяват или дори разрушават първоначалната структура на водата. Степента на проява на тази тенденция зависи от размера на заряда и конфигурацията на частицата (фигура 1). При това около йоните, полярните молекули и мицелите се образува двуслойна хидратна обвивка, състояща се от плътен слой от ориентирани молекули на водата (слой A) и по-рехав слой (слой B) от полуориентирани молекули на водата.
Може да се счита, че плътният слой на хидратната обвивка (слой A) се състои от водородни връзки между свързани помежду си водни кластери, структурата на които е специфична в зависимост от природата на хидратиращата се частица. Този слой е достатъчно здрав, строго подреден под въздействието на електрическото поле, а молекулите на водата в този слой са като "замразени". По време на електролиза той се движи заедно с ионите. Дебелината на слоя се определя от заредеността на иона (частицата), т.е. отношението на големината на заряда на иона (частицата) към неговия (нейния) диаметър. Слоят A става известен като слой на първичната хидратация или първична хидратна обвивка.
Вторичният хидратен слой (слой B) е по-слабо свързан с иона, това е своеобразна зона на "топене", разположена между зоната A и зоната C, където се запазва тетраедричната структура на чистата вода. Т.е. молекулите на водата могат да се движат от зона B към зона C и обратно.
Средното време на живот на молекулите на водата в хидратната обвивка зависи от природата на частицата, концентрацията на разтворените вещества и температурата.
През 1951 г., след като са били установени координационните числа за различните електролити, се появява възможността да се изчислят концентрациите на електролитите, при които цялата вода в разтвора е включена в първите хидратни обвивки. Структурно такъв разтвор може да се представи схематично като система, съставена само от един слой хидратирани йони, които се допират един до друг със своите хидратни обвивки (зони A). Граничното условие за появата на такава система (т.е. концентрацията на електролита в разтвора) е наречено Граница на Пълната Хидратация на Водния Разтвор (ГПХ). За различните електролити тази концентрация се намира в интервала от 2,14 до 4,63 мола/л.
Координационните числа за различни електролити отразяват броя на водните молекули, които обграждат един йон в разтвора. Тези числа представляват степента на хидратация на йоните в разтвора. Ето някои примерни координационни числа за различни електролити:
- Натриев ион (Na⁺): 6 координационни водни молекули
- Калиев ион (K⁺): 6 координационни водни молекули
- Магнезиев ион (Mg²⁺): 6 или 8 координационни водни молекули
- Хлориден ион (Cl⁻): 6 координационни водни молекули
- Сулфатен ион (SO₄²⁻): Различни, обикновено 8-12 координационни водни молекули
Тези числа могат да варират в зависимост от условията на разтвора, като температурата и концентрацията на разтворените вещества. Координационните числа са важни за разбирането на структурата на хидратираните иони и взаимодействието им с водата в разтвор.
При разреждането на разтвора молекулите на вода започват да формират вторичната хидратна обвивка (зона B). Концентрацията на разтвора, при която цялата налична вода влиза в първичната и вторичната хидратни обвивки, е наречена Граница на Далечната Хидратация на Водния Разтвор (ГДХ).
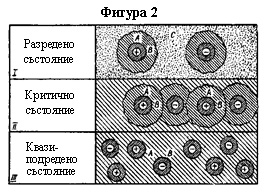 Ако разгледаме какво се случва при концентрирането на разтвора (фигура 2), в разреждания разтвор съществуват както ГДХ (слоя A + слоя B), така и слой C с тетраедрична структура на чистата вода (състояние 1). С увеличаването на концентрацията на разтвора (добавяне на електролит към разтвора), първо се изчерпва свободната вода от слоя C (състояние 2I), а след това и слоят на вторичната хидратация (слоя B), докато се достигне образуването на ГПХ (състояние 3).
Ако разгледаме какво се случва при концентрирането на разтвора (фигура 2), в разреждания разтвор съществуват както ГДХ (слоя A + слоя B), така и слой C с тетраедрична структура на чистата вода (състояние 1). С увеличаването на концентрацията на разтвора (добавяне на електролит към разтвора), първо се изчерпва свободната вода от слоя C (състояние 2I), а след това и слоят на вторичната хидратация (слоя B), докато се достигне образуването на ГПХ (състояние 3).
Процесът на обратна осмоза винаги е свързан с концентрирането на разтворите, поради което ще разгледаме как се променят основните характеристики на мембраната - относителната производителност (G) и способността за задържане (R) с нарастването на концентрацията (C1).
С нарастването на концентрацията в системата "вода - разтворено вещество - мембрана" се наблюдават следните изменения:
- Свободната вода преминава първо във вторичните хидратни обвивки (ГДХ), а след това - в първичните (ГПХ). Размерът на хидратирания йон се намалява.
- Осмотичното налягане на разтвора нараства пропорционално на C1, което намалява движещата сила на преноса през мембраната при постоянно работно налягане.
- Дебелината на слоя свързана вода намалява поради конкуренцията за вода между ионите и полярните групи на материала на мембраната в полза на ионите.
От това описание следва изводът, че и относителната производителност, и способността за задържане трябва да намаляват с нарастването на концентрацията, което се наблюдава в експеримента (фигура 3)
Фигура 3. Зависимост на задържащата способност (R) и относителната производителност (G) на ацетатцелулозна мембрана от концентрацията на сол в началния разтвор
От тази графика е ясно, че намаляването на G и R започва, когато в разтвора "изчезва свободната вода" (достига стойността на ГДХ), а G и R стават нула в зоната, близка до стойността на ГПХ.
Тъй като през мембраната минава един компонент, а другият се задържа от нея, неизбежно се случва промяна в съотношението на концентрациите в обема на началния разтвор. В крайна сметка това е целта на провеждането на процеса на мембраннота разделяне, но тези промени са разпределени много неравномерно в обема на разтвора. Затова се появяват така наречените поляризационни явления на мембраната, т.е. събития, които се случват в тънък слой на разделяната смес в близост до повърхността на мембраната поради нейната полупроницаемост.
Ще разгледаме типичната картина на такова разпределение по отношение на компонента, който се задържа от мембраната.
По дължината на мембраната тече поток от началния разтвор с обемен дебит W и концентрация на задържания компонент Co. Под влиянието на движещата сила (градиент на налягането) през мембраната преминава поток на пермеата G с концентрация на компонента Cp < Co. Поради това, че вода се оттича от слоя на разтвор, прилепнал към мембраната, концентрацията на компонента в този слой расте с приближаването към повърхността на мембраната. На фигура 4 е показан стационарен процес при W = const, G = const.
Фигура 4. Разпределението на задържания от мембраната материал върху повърхността на мембраната
Дебелината на слоя, в който става забележим растеж на С, е δ, а максималната концентрация на повърхността на мембраната е Сm. Благодарение на това, че Сm > Co, се случва дифузионен пренос на компонента от мембраната в ядрото на потока D * dc/dx.
Този характер на промяната в концентрацията ще бъде еднакъв за всякакъв компонент, задържан от мембраната - неорганични йони и соли, водоразтворими органични съединения, включително високомолекуларни такива, както и за колоидни и суспендирани частици.
Ясно е, че всички баромембранни процеси са съпътствани от поляризационни явления. Разликите ще бъдат в това, че различните вещества се държат по-различен начин при концентриране: за някои може да бъде превишен разтворимостният им предел и те ще образуват утайка, някои ще образуват пространствени мрежи и ще се превърнат в гел, някои ще започнат да се натрупват върху мембраната заради адсорбция и повърхностни сили. На фигура 5 тези ситуации са условно показани като допълнителни съпротивления на масовия трансфер през мембраната.
Фигура 5. Различни видове съпротивления на масовия трансфер през мембраната
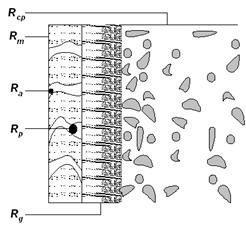 Rp – запушване на порите; Ra – адсорбция; Rm – мембрана;
Rp – запушване на порите; Ra – адсорбция; Rm – мембрана;
Rg – гел слой; Rcp – слой с повишена концентрация на разтворени вещества.
Като цяло, интензивността на образуването и устойчивостта на задържането на отлаганията върху мембраната зависят от порестостта на мембраната, заряда и степента на хидрофилност на нейната повърхност, концентрацията на частиците и примесите в началната вода, тяхната природа и размери, температурата и pH стойността, наличието на условия за адсорбция, химичното взаимодействие, образуването на кристали и възможността за полимеризация на веществата на повърхността на мембраната, както и други фактори. Няма обща теория за процесите на образуване на отлагания върху мембраните, затова в инженерната практика често се използват експериментални и експлоатационни методи за оценка.
Всички отлагания и утайки, които се образуват в обратноосмосния модул, обикновено се делят на три големи групи, които се различават както по състав, структура и размер на частиците на утайката, така и по механизма на формиране на отлаганията:
- Утайки от суспендирани, коллоидни частици и микроорганизми.
- Отлагания от трудноразтворими съединения.
- Отлагания от високомолекуларни органични вещества.
Ще разгледаме последователно тези три групи.
II. УТАЙКИ ОТ СУСПЕНДИРАНИ И КОЛОИДНИ ЧАСТИЦИ
 И така, към първата група се отнасят утайките от суспендирани и колоидни частици, както и микроорганизмите. С други думи, основната маса от утайките в тази група се състои от микрочастици с органичен и неорганичен произход, които идват както от входящата, така и се образуват по време на предварителната обработка на входящата вода преди обратната осмоза, при взаимодействие с технологичните филтриращи средства, конструктивните елементи на системата и атмосферата.
И така, към първата група се отнасят утайките от суспендирани и колоидни частици, както и микроорганизмите. С други думи, основната маса от утайките в тази група се състои от микрочастици с органичен и неорганичен произход, които идват както от входящата, така и се образуват по време на предварителната обработка на входящата вода преди обратната осмоза, при взаимодействие с технологичните филтриращи средства, конструктивните елементи на системата и атмосферата.
Преди всичко това са хетерогенни частици с различна дисперсност: колоидни и суспендирани неорганични и органични вещества (различни прахове, оксиди и хидрооксиди на метали, пясък – неразтворен SiO2, глина и боксити, асоциирани с органични вещества и високомолекулярни органични съединения (ВМС) и др.), както и микроорганизми, които образуват биофилм по повърхността на мембраната.
Суспендираните микрочастици с размери от 1 до 25 микрона, които присъстват във входящата вода, могат да блокират (запушат) каналите между слоевете мембрани и при висока скорост по повърхността на мембраната могат да окажат своеобразно абразивно въздействие, което означава, че са способни механично да повредят бариерния слой на мембраната. Това обикновено води до необратимо повреждане на мембраните.
 В някои случаи замърсяванията на напорния канал на обратноосмотичния елемент могат да доведат до извеждане на системата от строй. Например, при замърсяване на уплътнението-турбулатор-разделител на спираловиден обратноосмотичен елемент, разликата в налягането между неговите два края може да се увеличи, докато не настъпи разрушаване на елемента поради телескопично изместване на слоевете на ролката (спиралата) един спрямо друг (така нареченият "телескопинг" от английски). В този случай може да се стигне до "пропускане" на входящата вода в пермеата, което се забелязва с рязък и внезапен ръст на производителността на системата и нарастване на солеността на пермеата.
В някои случаи замърсяванията на напорния канал на обратноосмотичния елемент могат да доведат до извеждане на системата от строй. Например, при замърсяване на уплътнението-турбулатор-разделител на спираловиден обратноосмотичен елемент, разликата в налягането между неговите два края може да се увеличи, докато не настъпи разрушаване на елемента поради телескопично изместване на слоевете на ролката (спиралата) един спрямо друг (така нареченият "телескопинг" от английски). В този случай може да се стигне до "пропускане" на входящата вода в пермеата, което се забелязва с рязък и внезапен ръст на производителността на системата и нарастване на солеността на пермеата.
Микрочастиците с по-малки размери и коллоидите, заедно с други утайки, които обикновено са свързани с втората група (за която ще споменем по-долу), и микроорганизмите образуват отлагания на повърхността на мембраната, което предотвратява нейната нормална работа.
 На практика количество суспендирани частици във водата често се свързва с показателя за мътност, чийто аналитичен контрол се извършва с оптични и фотометрични методи (ГОСТ 3351). Въпреки това, по отношение на разделителната способност на тези методи за измерване, т.е. размерите на микрочастиците в анализираната вода, при използване на фотометри (турбидиметрични или нефелометрични методи на измерване), може с увереност да се каже, че тяхната реална разделителна способност е 1–1,5 микрона, а при визуалното определение на мътността (по степента на мътност на стълб с височина 10–12 см в измервателна колба за определяне на мътността) – над 2–3 микрона. Така че, при измерване на показателя за мътност, частиците с размер по-малък от 1 микрон, включително коллоидите, не се регистрират с тези методи. Тук трябва да се отбележи, че според многогодишни изследвания по време на експлоатацията на баромембранни устройства най-опасните се оказват микрочастиците с размер под 0,45 микрона. Микрочастиците с такива размери могат да бъдат "измерени" с помощта на лазерен брояч на микрочастици, чиято работа се основава на метода за определяне на размерите на микрочастиците чрез интензивността на разсейването на светлината под малък ъгъл. Приборите от този клас са способни не само да разпознават размера на микрочастиците, но и да определят тяхното количество в определен обхват. Въпреки това този метод за измерване на количеството микрочастици може да бъде извършван само в лабораторни условия, освен че е доста трудоемък и скъп.
На практика количество суспендирани частици във водата често се свързва с показателя за мътност, чийто аналитичен контрол се извършва с оптични и фотометрични методи (ГОСТ 3351). Въпреки това, по отношение на разделителната способност на тези методи за измерване, т.е. размерите на микрочастиците в анализираната вода, при използване на фотометри (турбидиметрични или нефелометрични методи на измерване), може с увереност да се каже, че тяхната реална разделителна способност е 1–1,5 микрона, а при визуалното определение на мътността (по степента на мътност на стълб с височина 10–12 см в измервателна колба за определяне на мътността) – над 2–3 микрона. Така че, при измерване на показателя за мътност, частиците с размер по-малък от 1 микрон, включително коллоидите, не се регистрират с тези методи. Тук трябва да се отбележи, че според многогодишни изследвания по време на експлоатацията на баромембранни устройства най-опасните се оказват микрочастиците с размер под 0,45 микрона. Микрочастиците с такива размери могат да бъдат "измерени" с помощта на лазерен брояч на микрочастици, чиято работа се основава на метода за определяне на размерите на микрочастиците чрез интензивността на разсейването на светлината под малък ъгъл. Приборите от този клас са способни не само да разпознават размера на микрочастиците, но и да определят тяхното количество в определен обхват. Въпреки това този метод за измерване на количеството микрочастици може да бъде извършван само в лабораторни условия, освен че е доста трудоемък и скъп.
Nicomp 380

За да се опрости процедурата за определяне на количеството микрочастици, които влизат в мембранните инсталации с входящата вода, стандартите ASTM въвеждат коллоидния индекс или индекс на плътност на утайката (SDI - от английски Silt Density Index). Този индекс служи като характеристика за степента на замърсяване на водата с механични и коллоидни примеси и нейната пригодност за подаване в мембранни инсталации. Според съвременните изисквания на ASTM D-4189, SDI - индексът е задължителен първичен тест за качество на входящата вода, който общо показва вероятността за образуване на утайки от коллоидни и суспендирани вещества, способни да замърсят повърхността на мембранните елементи.
Измерването на SDI коллоидния индекс е експресен тест, който се извършва ежедневно (или при нужда, например седмично - след събиране на статични данни, които показват стабилността на SDI коллоидния индекс на входящата вода). Вземането на проби от водата обикновено се извършва след патронните филтри преди подаването на водата в мембранната секция. Тестът може да се използва също и за контрол на ефективността на работата на осветителите, напорните механични филтри - както насипни, така и патронни (мрежести, дълбоки, повърхностни и други), филтрите за обезжелезяване и други. Методиката на SDI не може да бъде използвана за оценка на ресурса на мембранните елементи, тъй като няма ясни корелации между състава на входящата вода и стойността на SDI-индекса.
Silt Density Index (SDI) е индекс за плътност на суспендираните частици в единица обем на водата и определя намаляването на производителността на мембраните поради формирането на замърсявания на тяхната повърхност от суспендирани и коллоидни микрочастици. Методиката за определяне му се основава на измерване на времето за филтриране на определен обем входяща вода (обикновено 500 мл) през калибрирана микрофилтрационна мембрана с порозитет 0,45 микрона при постоянно разлика в налягане от 0,207 МПа (30 psi) и постоянна температура. Изборът на размер на порите на мембраната - 0,45 микрона, е обоснован с това, че размерът на микрочастиците с еквивалентен диаметър от 0,45 микрона представлява преход от разтворено състояние към суспендно.
Според стойностите на SDI15 може да се направи заключение за сложността на необходимата предварителна обработка на водата за мембранни процеси:
- SDI < 5 Не се изисква предварителна обработка.
- SDI 5 – 10 Изисква се едностепенна предварителна обработка.
- SDI > 10 Изисква се двустепенна предварителна обработка.
Таблица 1. Значениятa на индекса SDI (Silt Density Index) за типични природни водни източници
| Тип на входящата вода | максимум SDI | минимум SDI |
| Артезианска | 5 | 2 |
| Повърхностна | 175* | 5 |
* -за някои открити водоизточници стойността на SDI индекса може да достигне 500.
Допустимата критична стойност на индекса SDI може да служи като индикатор за класа на мембранните елементи (за водещите производители, стойността на SDI-индекса за началната вода (SDI15) се приема: за артезианска вода - до 5; за повърхностна вода - до 18).
За намаляване на стойността на SDI се прилага предварителна обработка на входящата вода. Обикновено за премахване на суспендирани частици и колоиди се използват добре познатите методи като филтрация и коагулация.
III. УТАЙКИ ОТ МИКРООРГАНИЗМИ, ОБРАЗУВАНЕ НА БИОФИЛМ
Специалистите, занимаващи се с обслужването на системи за обратна осмоза, често се сблъскват с явлението на натрупване на слиз върху мембраните, т.е. по повърхността на елемента за обратна осмоза (ОО) и неговия корпус.
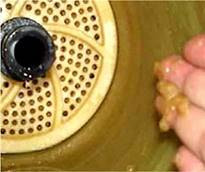 Такава слиз може да бъде открита и в самата ОО-мембрана. По-правилното наименование за този вид слиз е "биофилм" - колонии от микроорганизми, закрепени и развити на повърхността на мембранията на ОО-елемент.
Такава слиз може да бъде открита и в самата ОО-мембрана. По-правилното наименование за този вид слиз е "биофилм" - колонии от микроорганизми, закрепени и развити на повърхността на мембранията на ОО-елемент.
Вече разгледахме процеса на формиране на биопфилм в системите за водоподаване в една от нашите публикации, така че тук само ще се спрем върху особеностите, които са свойствени за този процес, който се извършва на ОО-мембрани. Биохимичното въздействие на микроорганизмите върху асиметричните полупроницаеми мембрани за ОО се счита за по-опасно от химическото разрушаване на мембраните под влияние на окислители. При определени условия, биофилмът може да разруши горния активен слой на мембраната до поддържащия слой, чиято порестост е съизмерима с размерите на бактериите. Това е особено опасно при производството на питейна вода, тъй като в този случай е възможно попадането на патогенни микроорганизми и вируси от входящата вода във филтрата (пермеата).
Процесът на закрепване на микроорганизмите на повърхността на мембраната предимно зависи от свойствата й: материала, от който е направена мембраната, грапавостта на повърхността й, хидрофобността и повърхностния й заряд.
Конструкцията на спиралните ОО-мембранни елементи и условията на повърхността на мембраната са идеални за закрепване, натрупване и растеж на микроорганизми. Защо? Първо, огромната повърхност на мембраната; второ, височината на слоя на повърхността, разделен от водата - мембраната е ограничена, а самият слой е наситен с хранителни вещества заради концентрационната поляризация. Трето, в тесните пространства на каналите на турбулентните решетки, които разделят мембранните слоеве, скоростта на водата е относително ниска (около 0,1 м/с), а турбулентността е ограничена. И накрая, някои полимерни материали, като например ацетилцелулозата, са добра среда за растеж на микроорганизми. Това създава предпоставки за развитие на колонии от микроорганизми на повърхността на мембраната, а продуктите от тяхната жизнедейност могат да предизвикат структурни промени в полимера на мембраната, особено в структурата на нейния тънък активен слой, което води до влошаване на характеристиките на процеса на обратно осмотичното обезсоляване.
В глава 6. на настоящата публикация разгледахме принципната конструкция на спираловидно-навития обратноосмотичен елемент. Кратко напомняме: в тази конструкция, върху централната тръба, през която се отвежда пермеатът, се навива "сандвич", състоящ се от две ОО-мембрани, турбулентни решетки и уплътнения за събиране на пермеата.
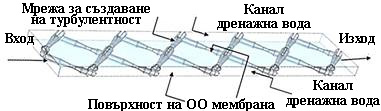 За създаване на турбулентност върху решетката движението на течността се осъществява обикновено по дължината на диагонала на ромба на решетката, поради което около всеки кръстосан участък на решетката могат да се образуват малки застойни зони, където започва растеж на биологични отлагания.
За създаване на турбулентност върху решетката движението на течността се осъществява обикновено по дължината на диагонала на ромба на решетката, поради което около всеки кръстосан участък на решетката могат да се образуват малки застойни зони, където започва растеж на биологични отлагания.
При това основният механизъм за транспорт на микроорганизмите към повърхността на мембраната е обусловен от хидродинамичната сила. При липса на движение на водата (например при престой на обратноосмотичната инсталация) транспортът на клетките към повърхността на мембраната може да се осъществи чрез броуново движение или хемотаксис (движение на организми или техните клетки в резултат на химични сигнали или градиенти на концентрация на химични вещества). Растежът на биологичното обрастване продължава, докато динамиката на потока не се промени, т.е. докато не се променят условията за транспорт и закрепване на микроорганизмите (например, при хидравлични удари или промяна в състава на водата).
Това е първата стъпка към формирането на биофилм на повърхността на мембраната. След това следва имобилизация (закрепване) на микроорганизмите на повърхността на мембраната чрез електрокинетично или хидрофобно взаимодействие между клетката и повърхностните молекули на мембраната. След това започва растежът и размножаването на клетките както за сметка на разтворимите хранителни вещества във входящата вода, така и за сметка на веществата, адсорбирани от повърхността на мембраната. Този растеж и размножаване на клетките са съпроводени от изтичането на междуклетъчна среда (полизахарид), която закрепва клетката като котва за повърхността, "захваща" и закрепва други клетки върху субстрата и по този начин стимулира микробната колонизация на повърхността на мембраната.
Освен това, образувалия се биофилм може да действа като "капан" за суспендирани частици, които, от своя страна, могат бързо да създадат плътни наслоявания върху мембраната.
Съществуват редица показатели, промените на които могат да помогнат на оператора да определи, дали вероятната причина за намаляване на производителността на обратноосмотичната инсталация е биообрастване. Тези показатели включват:
- увеличаване на спада на налягането върху инсталацията;
- намаляване на потока на водата през мембраните (намаляване на изхода на пермеата);
- намаляване на качеството на пречистваната вода (увеличение на специфичната проводимост на пермеата);
- наличие на слизести наслоявания върху входните картриджни филтри.
Количеството на родовете и видовете микроорганизми, присъстващи на повърхностите на мембраните за обратна осмоза (ОО), може да бъде доста разнообразно и общо казано зависи от източника на водоснабдяване, неговата организация и последващите стъпки за предварителна обработка вна водата преди достигането на ОО-мембрана. Микроорганизмите, присъстващи в постъпващата (входящата) вода, могат да включват бактерии, гъби и дрожди. Редовно на повърхността на мембраната се откриват бактерии, принадлежащи към родовете като Коринебактерии (Corynebacterium), Псевдомонади (Pseudomonas), Актиномицети (Actinomyces), Флавобактерии (Flavobacterium), Аеромонази (Aeromonas), бактерии от рода Артробактер и др. От гъбите се срещат пеницилини (Penicillium), муцори (Mucor), триходерми (Trichoderma), фузарии (Fusarium), аспергили (Aspergillus) и др. От дрождите са забелязани Кандиди (Candida), Пихии (Pichia), Липомицети (Lipomyces), дрожди от рода Амброзиозима и др. Най-често в системите за водоснабдяване преобладава родът Псевдомонади (Pseudomonas), който се отнася към "добрите производители" на полизахариди - основния компонент на слизта.
Общото количество бактерии, обнаружени на повърхността на ОО-мембрана, обикновено варира между 106 и 108 КОЕ/см². Въпреки че е възможно да се знае предварително качественият и количественият микробиологичен състав на входящатата вода, е трудно да се предвиди кои родове и видове ще присъстват и преобладават в отлаганията върху ОО-мембрана. Общоприето е, че колкото по-малко микроорганизми има водата пред ОО-обработка, толкова по-малко е вероятно биообрастването. Затова обикновено се практикува определянето на общото микробно число (ОМЧ) във входящата вода преди обратната осмоса като мониторинг. Като универсално средство за защита на обратната осмоза от биообрастване се счита надеждната предварителна обработка на входящата вода.
Оказва се, че ефикасното премахване както на самите микроорганизми, така и на хранителните вещества, които те използват в процеса на своя живот, е най-добрият начин за ограничаване на растежа на микроорганизмите. Затова за предварителната обработка на началната вода се използват процеси като дезинфекция с биоциди, пропорционално дозиране на коагуланти и флокуланти, и многостепенна филтрация: механична филтрация, каталитично обезжелязване, адсорбционно почистване, микрофилтрация и, при необходимост, омекотяване. Същите процеси се използват и за премахване на суспендирани частици от входящата вода.
Накрая трябва да се отбележи, че не малка роля за предотвратяването на биообрастването и премахването на биофилма по време на експлоатацията на ОО-инсталации играят процесите на периодично химическо почистване и дезинфекция на ОО-модули с помощта на устройства за химическо промиване. За това ще говорим отделно в следващата статия.
IV. ОТЛАГАНИЯ И УТАЙКИ ОТ ТРУДНОРАЗТВОРИМИ СЪЕДИНЕНИЯ
В глава 5, посветена на концентрационната поляризация, вече споменахме, че в резултат на този феномен може да се образува "...натрупване на повърхността на мембраната на отлагания от някои малко разтворими соли в резултат на тяхната концентрация близо до повърхността на мембраната".
Кои трудноразтворими съединения могат да се отлагат на повърхността на мембраната? За да отговорим на този въпрос, ще се обърнем към качествените показатели, по които се сертифицира входящата вода, а именно към йонния баланс на входящата вода.
Вече повече от веднъж подчертавахме, че преди проектирането на система за обратна осмоза трябва да се извърши пълен и точен анализ на входящата вода. Освен общите показатели като рН, мътност, цветност, съдържание на твърди частици, перманганатна окисляемост, щелочност (количество алкални вещества), обща твърдост, карбонатна твърдост, минерализация, замърсяване с микроорганизми, съдържание на активен и свързан хлор и други, протоколът за анализ на водата трябва да включва името и концентрацията на следните компоненти във водата (Таблица 2):
Таблица 2
| Катиони | мг/л | мг-екв./л | % | Аниони | мг/л | мг-екв./л | % |
| Калций (Ca2+) | Бикарбонати (HCO3–) | ||||||
| Магнезий (Mg^2+) | Карбонати (CO32−) | ||||||
| Натрий (Na+) | Сулфати (SO42–) | ||||||
| Калий (K+) | Хлориди (Cl–) | ||||||
| Желязо (Fe2+) | Флориди (F–) | ||||||
| Желязо (Fe3+) | Нитрати (NO3–) | ||||||
| Манган (Mn2+) | Нитрити (NO2–) | ||||||
| Алуминий (Al3+) | Фосфати (PO43–) | ||||||
| Амоний (NH4+) | Борати (B) | ||||||
| Барий (Ba2+) | Сулфиди (S2–) | ||||||
| Стронций (Sr2+) | Кремниев диоксид (SiO2) | ||||||
| Мед (Cu2+) | |||||||
| Цинк (Zn2+) | |||||||
| Сума катиони Σ | 100% | Сума аниони Σ | 100% |
Границите за откриване на катионите Ba2+ и Sr2+ трябва да бъдат не повече от 1 мкг/л (1 ppb) и не повече от 1 мг/л (1 ppm) съответно.
При това общото съдържание на катиони във водата, изразено в мг-екв./л, трябва да бъде равно на общото съдържание на аниони, изразено в мг-екв./л. Йонният баланс на водата се постига само при това условие. Комбинирайки катионите и анионите, присъстващи във входящата вода и използвайки информацията от Таблица 3, лесно може да се убедите, че в практически всяка вода може да се образуват трудноразтворими съединения.
Таблоца 3
| Наименование на химичното съединение | Химична формула | Температияр оС | Пределна разтворимост |
| Алуминиев хидроксид | Al(OH)3 | 25 | 3∙10–34 |
| Алуминиев фосфат | AlPO4 | 25 | 9,84∙10–21 |
| Бариев карбонат | BaCO3 | 25 | 2,58∙10–9 |
| Бариев сулфат | BaSO4 | 25 | 1,1∙10–10 |
| Калциев карбонат | CaCO3 | 25 | Калцит: 3,36∙10–9 Арагонит: 6∙10–9 |
| Калциев вторид | Ca3(PO4)2 | 25 | 3,45∙10–11 |
| Калциев сулфат | CaSO4 | 25 | 2,07∙10–33 |
| Калциев сулфид | CaS | 25 | 4,93∙10–5 |
| Железен (II) хидроксид | Fe(OH)2 | 25 | 4,87∙10–17 |
| Железен (II) сулфид | FeS | 25 | 8∙10–19 |
| Железен (III) хидроксид | Fe(OH)3 | 25 | 2,79∙10–39 |
| Железен (III) фосфатен дихидрат | FePO4 • 2H2O | 25 | 9,91∙10–16 |
| Магнезиев амониев фосфат | MgNH4PO4 | 25 | 2,5∙10–13 |
| Магнезиев карбонат | MgCO3 | 12 25 |
2,6∙10–5 6,82∙10–6 |
| Магнезиев фторид | MgF2 | 18 25 |
7,1∙10–9 5,16∙10–11 |
| Магнезиев фосфат | Mg3(PO4)2 | 25 | 1,04∙10–24 |
| Манганов хидроксид | Mn(OH)2 | 18 25 |
1,2∙10–11 5,61∙10–12 |
| Стронциев карбонат | SrCO3 | 25 | 5,6∙10–12 |
| Стронциев сулфат | SrSO4 | 17,4 | 3,8∙10-7 |
| Цинков карбонат | ZnCO3 | 25 | 1,46∙10–10 |
Въпросът остава само един - дали тяхната концентрация ще достигне предела, при който започва отлагането на тези вещества като утайка. Отговорът на този въпрос е очевиден - опитът от експлоатацията на системите за обратна осмоза показва, че се случват ситуации, когато трудноразтворимите соли се концентрират върху ОО-мембрани при нива над техния предел на разтворимост. Дори е съставен списък от трудноразтворими соли подредени според увеличаването на проблемите с тяхното отлагане върху повърхността на мембраните:
CaCO3 > CaSO4 > Силикати > SrCO3 > BaSO4 > SrSO4 > CaF2 > CaSiO3 > MgSiO3 > Ca3(PO4)2 > Fe(ОН)2
Ще се опитаме да разясним това подреждане:
IV-1. ОТЛАГАНИЯ НА КАЛЦИЕВ КАРБОНАТ
Обикновено всички природни води съдържат хидрокарбонати и карбонати, които предимно определяват щелиновия индекс на водата или карбонатната твърдост. Процесът на образуване на карбонати и хидрокарбонати е заложен във водния кръговрат в природата: при падането на валежите на земята във водата се разтваря въглероден диоксид от въздуха и се образува въглеродна киселина (H2CO3), като концентрацията й във водата е около 0,05%:
H2O + CO2 → H2CO3
Въглеродната киселина във воден разтвор се дисоциира на две стъпки:
H2CO3 ↔ H+ + HCO3¯;
HCO3¯ ↔ H+ + CO32¯
След като премине през почвата, "киселата вода" (слаб разтвор на въглеродна киселина) отмива калциев карбонат от земните породи, което води до образуването на хидрокарбонати. Водата от повечето природни извори е близка до насищане с калциев карбонат. В зависимост от pH на водата калциевият карбонат се намира в равновесие с калциевия бикарбонат и разтворения въглероден диоксид:
CaCO3 + H2O + CO2 ↔ Ca2+ + 2HCO3¯
или опростено в йонна форма:
CaCO3 + H+ ↔ Ca2+ + HCO3¯
Установено е, че ако pH е по-ниско от 8,3, бикарбонатната щелиновост (и карбонатната твърдост) ще бъде балансирана чрез определено съдържание на разтворения вода въглероден диоксид. При pH над 8,3, хидрокарбонатите (HCO3–) ще се превърнат в карбонати (CO32–). Тоест, когато стойността на pH намалее, равновесието в уравнението може да се отмести надясно и обратно.
Така при концентриране на входящата вода в премембранния слой равновесието в уравнението на реакцията започва да се отмества наляво (водата се отдалечава от слоя). Освен това част от свободната въглеродна киселина заедно с водата също преминава през ОО-мембрана в пермеата. В резултат на това стойността на pH в концентрата се повишава. В резултат на това въглеродното равновесие в премембрания слой на водата се отмества – образува се излишък от карбонатни йони, които влизат във взаимодействие с калциевите йони.
От това следва, че за избягване на образуването на отлагане от калциев карбонат, стойността на pH в потока на концентрата трябва да бъде по-ниска от стойността на рН, при която в потока на концентрата калциевият карбонат е в равновесие с калциевия бикарбонат (насищане) – pHs.
Разликата между стойността на pH на концентрата и стойността на pH на насищане (pH – pHs) се нарича индекс на Ланжелие (LSI - Langelier Saturation Index), чийто знак определя карбонатната стабилност на водата и възможността за образуване на отлагания от калциев карбонат върху ОО-мембрана. За предотвратяване на образуването на карбонатни отлагания на повърхността на мембраната, LSI-индексът трябва винаги да бъде отрицателен. Това означава, че при проектирането на обратноосмотични системи за вода с висока щелочност е необходимо да се използват методи за предварителна обработка на водата, които ще помогнат да се намали индексът на Ланжелие, като например киселообразуване (пропорционално дозиране на киселинен разтвор) и омекотяване на началната вода или обработка с инхибитори на утоечното формиране - дозиране на антискейланти.
Контролът върху работата на обратноосмотичната система може да се извършва чрез измерване на стойността на pH на концентрата.

Какви са признаците, че се образуват отлагания от карбонат на калций на повърхността на ОО-мембрани?
-
Ниската селективност, намалена производителност и/или висок спад на налягането на отделна мембрана при изпитване. Следва да се има предвид, че това може да се забележи практически при всякакъв вид замърсяване на ОО-мембрана.
-
Образуване на отлагане с бял цвят по краищата на ОО-елементи (в отделни случаи образуване на отлагания в тръбопровода на концентрата и корпуса на държача на ОО-мембрана, която е инсталирана последно в ОО-система). Стойността, която трябва да се отбележи, е че бялото оцветяване на отлаганията от карбонат на калций е доста рядко. По-често отлаганията имат кремав или жълтеникав оттенък. При това както утайката, така и отлаганията се разтварят добре в разтвор на солна киселина с отделяне на мехурчета газ; и ако отлаганията съдържат само карбонат на калций, тогава образецът от отлагане трябва напълно да се разтвори в разтвора на киселината, и разтворът няма да промени своя цвят и ще остане прозрачен. Ако обаче след разтваряне в разтвора се наблюдават чужди частици или той променя цвета си, тогава освен карбоната на калций в отлагането се съдържат и други примеси.
- Увеличение на теглото на сухия ОО-елемент с 30-35% спрямо началното тегло (например, за елемент с размер 8” x 40” теглото надвишава 20 кг (при начално тегло от 15 кг). Този признак също е характерен за всякакъв вид отлагания.
IV-2. ОТЛАГАНИЯ НА СУЛФАТИ НА ЩЕЛОЧНОЗЕМНИ МЕТАЛИ
И ако скоростта на отлагане на калциевия карбонат върху ОО-мембрани силно зависи от pH, и борбата с този вид утайки може да бъде доста ефективна чрез подкисляване на входящата вода, то изключително ниската разтворимост на сулфатите на щеоловидните метали (калций, барий и стронций) и тяхната ниска химическа активност са основните фактори, ограничаващи границите на концентрацията на входящата вода в примембрания слой. Това е особено актуално, тъй като един от тези сулфати - калциев сулфат - е най-вероятниото и "най-тежко" отлагане от целия диапазон на разтворени соли в подземни и морски води. Той, от гледна точка на борбата с отлагането, създава най-големи проблеми и предизвиква съмнения и спорове сред учените по света относно избора на технологични параметри и условия за експлоатация на ОО-инсталации. Затова в световната практика се приема, че при проектирането на инсталации за обезсолване на вода с обратна осмоза максималната степен на концентрация на началната вода в примембраният слой се определя от условието "без утаяване" именно на калциевия сулфат, т.е. създаването в ОО-модула на такива условия, при които концентрацията на калциев сулфат в примембрания слой не надвишава предела на разтворимостта му. Но дори и такива мерки, както показва практиката, не са гаранция за избягване на отлагането по няколко причини, включително недостатъчната точност при изчисляване на пределите на разтворимост, разногласията в точността на изчисленията и моделирането на мембранните процеси по различни методики и програми, и несъвършенството на конструкцията на съвременните мембрани (както сами производителите признават), където в "зоните на застой" е възможно "зараждане на кристали".
В примембрания слой чрез преход от разтвора (от входящата вода) на водни молекули в пермеата (пречистената вода) може да започне бързо увеличаване на концентрацията на калциев сулфат, който има нисък предел на разтворимост ПРСаSО4 (42 ·10-6 мол/л), което води до образуването на голям брой зародиши на кристали CaSO4 и последващия им растеж. При условията, създадени в приповърхностния мембрания слой, калциевият сулфат рядко образува големи кристали, тъй като скоростта на образуване на зародиши е много висока. Обикновено образуващите се на ОО-мембрани кристали CaSO4 имат игловидна форма с дължина 5-10 мкм и ширина 1-3 мкм. При това, както показва практиката, силите на адхезия на отлаганията от калциев сулфат към повърхността на полупроницаемата мембрана са толкова слаби, че отделни кристали се движат свободно по дължината на мембраната от потока на водата, а монолитни блокове от тези отлагания се откъсват лесно от повърхността на мембраната.
При първо приближение, отлагането на калциевия сулфат може да бъде записано като уравнение:
aCa2+ + aSO42- ≥ ПРCaSO4
За приблизителни изчисления на процеса на обратна осмотична десолвация стойността на a се приема като равна на разтворимостта на чист гипс във вода. Въпреки това, при извършване на десолвация на реални води разтворимостта на CaSО4 обикновено зависи от йонния състав на водата, така че тя може както да се увеличи, така и да се намали в сравнение с разтворимостта в чиста вода.
Образуваните на повърхността на мембраната гипсови кристали стават центрове на кристализация и предизвикват "верижна" реакция на образуване на "гипсова" мембрана. Това всичко се случва при постоянен поток на концентрата и процесът става необратим. Този процес може да бъде много нагледно представен чрез процеса на кристализация на преситен раствор на натриев хлорид в така наречените "химически" бойлери.
Признаците, че на повърхността на ОО-мембрани се образуват отлагания от калциев сулфат, са подобни на тези, които споменахме по-горе за карбонатните отлагания, с изключение на това, че утайката и отлаганията не се разтварят в разтвор на солна киселина. При това скоростта на "запълване на ОО-мембрани" със сулфатни отлагания е много по-висока от скоростта при карбонатните отлагания.
Докато говорим за сулфатни отлагания, които се формират на повърхността на обратноосмотичните мембрани, освен калциевия сулфат, който е един от най-често срещаните замърсители, не можем да пренебрегнем другите сулфати от групата на щеоловидните метали: сулфатите на барий и стронций. Защо? Сулфатът на калций (CaSO4) е "добре" разтворим във водата в сравнение със сулфатите на барий (BaSO4) и стронций (SrSO4): сулфатът на барий е почти неразтворим - при 18°C само 0,22 мг BaSO4 се разтварят в 100 г вода; разтворимостта на сулфата на стронций е по-висока - 11,3 мг SrSO4 в 100 мл вода при 0°C.
Разбира се, йонът на калций (Ca2+) присъства в естествените водни източници в по-голямо количество от катионите Ba2+ и Sr2+, и CaSO4 по-често предизвиква замърсяване в сравнение с BaSO4 и SrSO4, но ако последните вече се отложат, това води до образуването на отлагания от малкоразтворими вещества, които могат да кристализират в съединения със сложна химична структура. При отлагането на сулфат на бария върху обратноосмотичната мембрана стават видими (при увеличение) ромбовидни кристали, които имат различни стойности на разтворимост и предизвикват вече споменатата "верижна реакция" на кристализация в целия примембранен слой. Трябва да се отбележи, че по време на кристализацията BaSO4 "може да влече" със себе си значителни количества и други вещества, които се намират в разтвора, особено многовалентни йони, като сулфати на тривалентно желязо, тривалентен хром и алуминий. До момента не е ясно дали това явление е обусловено от адсорбция или е свързано с образуването на твърди разтвори.
В природата сулфатът на барий, BaSO4, е широко разпространен като минерал (тежък барит). Понякога тежкият барит се среща във формата на отделни добре оформени кристали, които принадлежат към ромбовидната система и се отличават с голямо разнообразие от форми (твърдост на тежкия барит: 3-3,5, плътност: 4,48). Въпреки това обикновено той образува влакнести, зърнести или плътни агрегати. Затова отлаганията от сулфата на бария върху ОО-мембрана, при увеличение, изглеждат като ромбовидни кристали. Поради това отлаганията от сулфат на бария върху повърхността на обратноосмотичната мембрана, в тръбопровода на концентрата и в корпуса на обратноосмотичната мембрана на допир наподобяват фина шкурка.

Тези "абразивни свойства" на кристалите от сулфат на бария могат да предизвикат повреди на ОО-мембрана по време на работа на системата. Тъй като адхезията на кристалите от сулфати на щеоловидни метали към ОО-мембрана е ниска, при стартиране / спиране на ОО-система, т.е. когато спейсърът на ОО-мембрана се движи леко, започва движението на кристалите, което може да предизвика необратими повреди на повърхността на ОО-мембрана и, съответно, да доведе до намаление на нейната селективност.
IV-3. ОТЛАГАНИЯ ОТ СИЛИЦИЙ
Отлаганията на повърхността на ОО-мембрани от силициеви съединения се формират чрез механизъм на образуване на утайки от колоидни частици, за които споменахме в раздел II на тази стантия, с някои различия.
Както е известно, в природната вода силицият присъства във формата на мета- (H2SiO3), орто- (H4SiO4) и поликремниеви киселини. Разтворимостта на силициевите киселини във вода е доста висока. При 25°C и рН 5 ~ 7 тя е около 100 ~ 120 мг/л (по SiO2) и намалява до 20 ~.25 мг/л при 5°C. Тъй като силициевата киселина е слаба киселина, тя главно се среща в недисоциирана форма при неутрално рН или по-ниско. При насищане силициевата киселина може да полимеризира, образувайки нерастворим колоиден диоксид на силиций или силикагел, който може да се отделя на повърхността на ОО-мембрана. Скоростта на формиране на утайки от силициевите киселини се определя от скоростта на тяхната полимеризация, която нараства с увеличаване на концентрацията. Поради това вероятността от отлагане на силиций в потока на концентрата и потока на входящата вода ще бъде значително различна поради увеличаването на концентрацията на SiO2 и изменението на pH стойността. Това може да се оцени чрез анализ на вхходящата вода и работните параметри на системата за обратна осмоза. Затова при проектирането на процеса на обратна осмоза максимално допустимата концентрация на SiO2 в концентрата се основава на разтворимостта на SiO2 и pH стойността. Въпреки това, дори при концентрации на силиций (по SiO2) до 150 мг/л, скоростта на полимеризация е много ниска и е възможно значително пренасищане на разтвора без образуване на силициеви отлагания в обратноосмотичните системи.
Температурата в обхвата 5 ~ 35°C не влияе съществено на скоростта на полимеризация и периода на коллоидна стабилност, през който пренаситените разтвори на силициевата киселина не губят своята коллоидна стабилност. С увеличаването на общото съдържание на сол във водата скоростта на полимеризация се увеличава, а периодът на коллоидна стабилност се намалява.
Силициевата киселина проявява селективно участие в химичните взаимодействия. Така силициевата киселина може да взаимодейства с катиони на желязо с окислително число +3 и да бъде напълно инертна спрямо йони на желязо с окислително число +2. След като стойността на pH превиши неутралната стойност, силициевата киселина се дисоциира, образувайки силикатен анион ([SiO32-]n), който може да реагира с калций, магнезий, желязо, марганец или алуминий, образувайки нерастворими силикати. Например образуваният силикатен калций CaSiO3 може да се изрази като CaO × SiO2.
В резултат на това химично взаимодействие се образуват стабилни колоидни формации, които не могат да се отстранят нито с филтриране, нито с отстояване. Тук следва да се отбележи, че силициевите силикати след своето втвърдяване (например при загряване) се превръщат в много устойчив материал.
Известно е, че алуминийят е най-ефективния утаител на силициевата киселина, а отлагането на силиций главно се наблюдава при присъствието на алуминий и желязо. Когато Al3+ и Fe3+ присъстват в предварително обработената входяща вода, отлагането на силиций се наблюдава дори при концентрации под предела на наситеност. Тъй като солите Al3+ и Fe3+ се използват за коагулация в муниципалната и индустриалната обработка на вода, чести и точни измервания на концентрацията на тези йони са необходими, дори когато самата входяяяяща вода не съдържа високи стойности на концентрация на алуминий и желязо. Замърсяванията със силикати на метали могат да възникнат поради химически процеси, реакции и отлагания, които се случват директно на повърхността на мембраната, както и поради колоидни примеси с частици от субмикронен размер, които не се задържат от филтрите, поставени на входа на мембранната система.
Значително влияние върху процеса на отлагане на силициевите съединения оказват и хидроксидите на метали, частичките от които сорбират на своята повърхност силициевите съединения, предизвиквайки образуването на силикатни замърсявания, които значително влошават показателите на обратната осмоза.
IV-4. ОТЛАГАНИЯ ОТ ЖЕЛЯЗО И МАНГАН
Отлагания от железни и манганови съединения по повърхността на ОО-мембрана се формират чрез механизъм на образуване на утаечни колоидни частици, за които споменахме в раздел II на тази статия.
Желязото е разпространен замърсител в почти всички водоснабдителни източници. В статията, посветена на деманганизацията на водата, отбелязахме, че "… премахването на желязото от водата (деферизация), намаляването на неговата концентрация до допустимите норми, е една от най-належащите задачи при обработката на вода." Съдържанието на желязо в различните водоснабдителни източници значително се различава както по отношение на формата на желязните съединения, така и по тяхната обща концентрация. Най-често желязото присъства във формата на разтворими соли Fe2+, които в последствие се окисляват до нерастворими соли Fe3+. Фините частици от този материал (или колоидното желязо) след окисление могат да преминават през предварителните филтри и да проникват в ОО-мембрани.
Има няколко теории, които обясняват процеса на образуване на отлагане от хидроксид на желязото по повърхността на ОО-мембрана. Според една от тях частиците желязо, проникнали в обратноосмотичната система, се задържат на места с ниска турбуленция - в "зоните на застой". Други предполагат, че скоростта на формиране на отлагане от желязни съединения върху мембраната не зависи нито от тяхната концентрация, нито от производителността на мембраната, нито от степента на турбуленция в потока на обработваната вода, а определящ фактор е природата на полупроницаемите мембрани, определяща степента на адхезия на колоидните частици желязо към повърхността на мембраната. Трети теории твърдят, че преходът от двувалентно към тривалентно желязо може да стане под влияние на микроорганизмите. Изследванията показват, че в системите за обратна осмоза са били открити желязобактерии, които са способни да окислят Fe2+ до Fe3+. При това даже и при филтриране на водата през филтри с порозитет 1 микрон не се осигурява защита на мембраните от замърсяване със съединения на желязо. Въз основа на този факт е направено заключението, че отговорни за процеса на отлагане на желязо на повърхността на мембраните са желязобактериите, заради жизнения процес на които колоидните частици от хидроксид на желязото се формират директно на повърхността на мембраните.

Признаците, че на повърхността на ОО-мембрана се образува отлагане от хидроксид на желязо, включват намаляване на селективността, скоростта на потока (производителността), увеличаване на спада на налягането (особено на първите елементи на ОО-мембрана) в системата за обратна осмоза; промяна на цвета на мембраната.
Мангановите соли са по-малко разпространени от железните соли и имат по-добра разтворимост от еквивалентните им железни соли, затова тяхното отстраняване е по-трудно. Често това се извършва чрез филтри с каталитично зареждане "GREENSAND", които се регенерират с калиев перманганат. Въпреки това, ако дозата на калиевия перманганат е прекалено голяма или той не е измит от филтъра с каталитично зареждане, при високи концентрации на перманганат калий във филтрата след тези филтри може да настъпи окисление на повърхността на мембраната, а при ниски се образува отлагане от манганов оксид по повърхността на мембраната.
Във всеки случай, контролът върху работата на системите за деферизация и деманганизация на етапа на предварителната обработка на водата преди системата за обратна осмоза трябва да бъде правилен и постоянен.

